行業(yè)動(dòng)態(tài)
您當(dāng)前的位置 > 行業(yè)動(dòng)態(tài) > 行業(yè)法規(guī)
20個(gè)國(guó)內(nèi)特有品種,迎來評(píng)價(jià)辦法
加入日期:2019/6/25 12:00:19 查看人數(shù): 1400 作者:admin
重磅!20個(gè)國(guó)內(nèi)特有品種,迎來評(píng)價(jià)辦法,不重新開展臨床試驗(yàn),國(guó)家藥監(jiān)局將不建議使用。
剛剛,國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心發(fā)布《國(guó)內(nèi)特有品種評(píng)價(jià)建議》的通知。

據(jù)通知,為落實(shí)原總局《關(guān)于仿制藥質(zhì)量和療效一致性評(píng)價(jià)工作有關(guān)事項(xiàng)的公告》(2017年第100號(hào))的要求,仿制藥質(zhì)量與療效一致性評(píng)價(jià)辦公室組織人員對(duì)《關(guān)于落實(shí)<國(guó)務(wù)院辦公廳關(guān)于開展仿制藥質(zhì)量和療效一致性評(píng)價(jià)的意見>有關(guān)事項(xiàng)的公告》(2016年第106號(hào))附件中的國(guó)內(nèi)特有品種進(jìn)行了梳理調(diào)研、專家論證和征求意見,明確了各品種的評(píng)價(jià)建議,現(xiàn)予發(fā)布。
企業(yè)應(yīng)當(dāng)承擔(dān)主體責(zé)任,根據(jù)原總局發(fā)布的《總局關(guān)于發(fā)布仿制藥質(zhì)量和療效一致性評(píng)價(jià)品種分類指導(dǎo)意見的通告》(2017年第49號(hào)),同時(shí)結(jié)合附件中的評(píng)價(jià)建議及相關(guān)技術(shù)指導(dǎo)原則,對(duì)國(guó)內(nèi)特有品種進(jìn)行深入研究。

根據(jù)原食藥監(jiān)總局2017年第49號(hào)文件的要求,針對(duì)國(guó)內(nèi)特有品種,由企業(yè)選擇可重新開展臨床試驗(yàn)證明其安全有效性,并參照《化學(xué)藥品仿制藥口服固體制劑質(zhì)量和療效一致性評(píng)價(jià)申報(bào)資料要求(試行)》提交申請(qǐng),后續(xù)審核通過后視同通過一致性評(píng)價(jià)。
企業(yè)未選擇重新開展臨床試驗(yàn)的,國(guó)家食品藥品監(jiān)督管理總局對(duì)外公布其缺乏有效性數(shù)據(jù),不建議使用。
可以看到,一致性評(píng)價(jià)的進(jìn)程由易到難,已經(jīng)從口服劑型、注射劑型,再到國(guó)內(nèi)特有品種了。雖然這些國(guó)內(nèi)特有品種缺少參比制劑,但是仍然需要滿足相關(guān)指導(dǎo)原則研究和評(píng)價(jià)要求。
而這些藥品是否將呈現(xiàn)有效的數(shù)據(jù),也將決定他們后續(xù)的命運(yùn)。
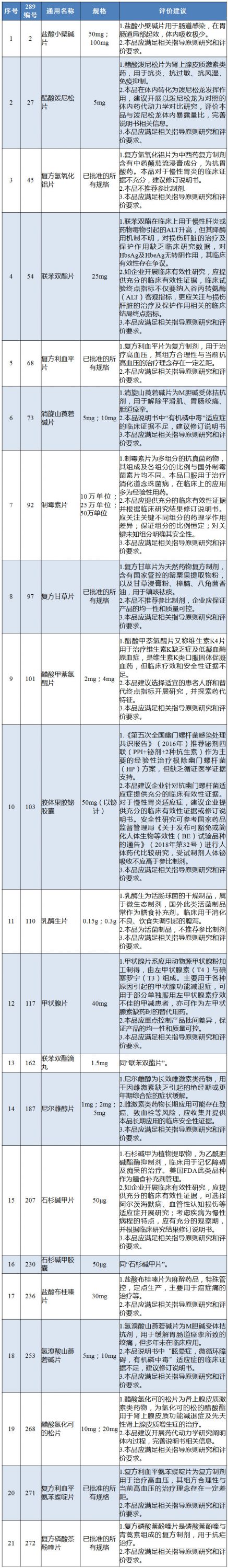
附:國(guó)內(nèi)特有品種評(píng)價(jià)建議
 德江县|
宝鸡市|
光泽县|
额济纳旗|
枣阳市|
大理市|
米林县|
雷州市|
金川县|
泌阳县|
武陟县|
铜陵市|
锡林浩特市|
凤阳县|
阜宁县|
乌恰县|
都江堰市|
搜索|
大埔县|
灵台县|
肇东市|
津市市|
灵川县|
元朗区|
巴林右旗|
原阳县|
溆浦县|
木兰县|
沂南县|
罗定市|
南通市|
扎兰屯市|
和静县|
沙洋县|
高雄县|
长寿区|
阿拉善左旗|
乌什县|
广水市|
阆中市|
偏关县|
德江县|
宝鸡市|
光泽县|
额济纳旗|
枣阳市|
大理市|
米林县|
雷州市|
金川县|
泌阳县|
武陟县|
铜陵市|
锡林浩特市|
凤阳县|
阜宁县|
乌恰县|
都江堰市|
搜索|
大埔县|
灵台县|
肇东市|
津市市|
灵川县|
元朗区|
巴林右旗|
原阳县|
溆浦县|
木兰县|
沂南县|
罗定市|
南通市|
扎兰屯市|
和静县|
沙洋县|
高雄县|
长寿区|
阿拉善左旗|
乌什县|
广水市|
阆中市|
偏关县|